世界上每两种不同硬度的任何矿物质,如果它们互相刻划,一定会有其中一种受到伤害。这是因为每一种矿物质,都有一个自己的硬度,两相刻划,受伤的肯定是那个硬度稍显脆弱的。而造成这种硬度不同的原因,缘于它们是由不同的“材料”组成的,组成“材料”的不同,导致了它们硬度的不同。
但自然界偏偏有两种奇葩物体的存在,实实在在违背着我们的这种普遍理解,这两种物体,就是石墨和金刚石,它们都是由碳原子组成的。你可能不相信石墨和金刚石是由同一种原子组成,但我们是有足够的科学依据的。
法国化学家拉瓦锡(1743〜1794)等人,在18世纪的70至90年代进行的在氧气中燃烧金刚石的实验中,发现最后得到的是二氧化碳气体,一种氧和碳的结合物。这个物质里的碳原子只能源于金刚石,所以,这个实验足以证明金刚石的材料是碳。

所不同的是,石墨是一种用我们的指甲就可以划伤的矿物质,大家都知道,我们的指甲,如果用玻璃来划,很轻易就会被划伤,而当玻璃碰到金刚石时,玻璃分分钟就变碎末。这就是说,从硬度上来排序,石墨<指甲<玻璃<金刚石。
真实情况是,就目前人类认知来说,还没有发现有任何一种矿物质的硬度能超过金刚石的。
那么问题来了:同样的一种材料碳原子组成的这两种不同的矿物质,为什么在硬度上相差就这么大呢?

虽然石墨和金刚石都是由碳原子这一同样材料组成,但由于组成它们的碳原子排列方式不同,从而导致了其硬度的巨大悬殊。
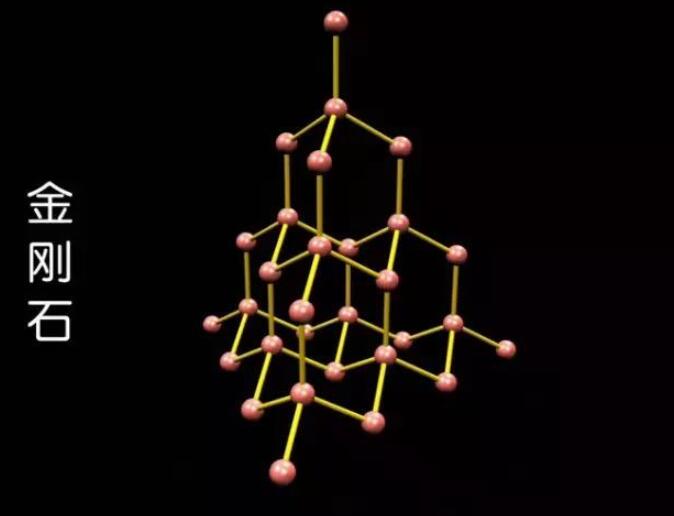
石墨分子中碳原子,是一层一层排列的,类似于只有横竖排列但又没固定结合点的架子,这样的架子我们都见过,是很容易被推散的,所以它的硬度当然就很低了。但金刚石就完全不同了。根据威廉·布拉格和他儿子观察、研究结果显示,金刚石可以说并不像其它矿物质那样,是由原子组成分子再由分子组成的,而是由碳原子,整齐交错的用一种每一个碳原子都和周围其它四个碳原子直接结合组成的四面三角体的形式,排列成紧密的立体结构,成为一个牢固的结晶体,这样一种致密的三维结构,是任何其它矿物质都无法模仿,进而超越的,所以金刚石才无比坚硬,成为世界硬度之王。

而且,这种无与伦比的构成结构,使得金刚石的密度大约是石墨密度的1.5倍,达到了为3.5克每立方厘米。天然的金刚石,是地下熔岩里的碳原子,在极高的温度和极大的压力下被挤压,经过天然结晶过程形成的,所以一般都隐藏在地球深处且产量稀少,故而其价值斐然。
不过人类在掌握了它的构成原理和组成结构后,现在已经能利用高温高压来人工制造金刚石了,这也是现在我们普通大众也很容易能买到钻石的一个原因所在。不过天然的金刚石因为其天然性和稀缺性,依然是极其昂贵的。
